Секрет стабильности коллагена. Автор инфографики: Университет Саймона ФрейзераИсточник: https://phys.org/
Исследования Университета Саймона Фрейзера в Канаде (Simon Fraser University, SFU) по-новому взглянули на одно из самых загадочных свойств коллагена. В статье, опубликованной в сборнике Proceedings of the National Academy of Sciences, профессор Нэнси Форд и аспирантка Алаа Аль-Шаер описали ключевые молекулярные особенности, которые помогают этому заведомо нестабильному белку сохранять свою структуру.
Коллаген составляет примерно 20% белка, содержащегося в нашем организме. Он обеспечивает стабильность соединительной ткани — сухожилий, костей, хрящей и кожи, образуя каркас, на котором растут и делятся клетки. Белок долгое время вызывал недоумение ученых. Как может молекула, априори структурно нестабильная при температуре тела +37°C, играть такую важную роль в поддержании целостности нашего организма и упругости соединительной ткани?

На тренировках мы стремися укрепить коллагеновый каркас в нашем опорно-двигательном аппаратеИсточник: Unsplash.com
Разгадка стабильности коллагена может стать ключом к пониманию того, как бороться с преждевременным старением и лечить заболевания, связанные с дефектами коллагеновых волокон, такие как остеопороз (ломкость костей), синдром Элерса-Данло и сахарный диабет.
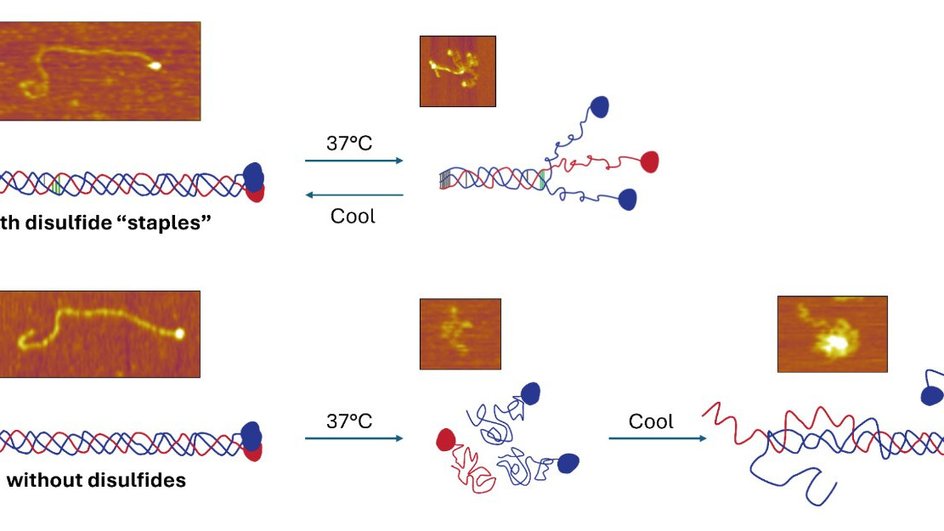
Отдельные молекулы коллагена слишком малы, чтобы их можно было разглядеть с помощью обычных световых микроскопов, поэтому Аль-Шаер использовала метод атомно-силовой микроскопии (АСМ) для получения изображений белков коллагена при различных температурах. По словам Форд, этот метод позволяет исследователям «чувствовать» объекты наподобие того, как незрячие люди читают шрифт Брайля.
В стабильном состоянии коллаген имеет структуру тройной спирали, состоящую из трех нитей, скрученных вместе наподобие шпагата или пряжи. При более высоких температурах эти нити расплетаются в произвольные витки. Аль-Шаер записал сотни изображений, чтобы отобразить этот процесс расплетения и то, как в некоторых случаях белки могли снова сворачиваться при охлаждении.
Было обнаружено, что аминокислоты, присутствующие в коллагене IV, называемые цистеинами, могут образовывать связи между отдельными нитями, которые могут повторно скреплять их вместе. Там, где эти «скрепки» существуют, коллаген IV не распадается при нагревании и с большей вероятностью восстанавливается при охлаждении. Коллагены без этих связей легче распадались и не могут быть собраны заново при охлаждении.
Во время поиска в базах данных последовательности белков, похожих цистеины, у животных, Аль-Шаер обнаружила, что этот химический компонент очень часто встречается в коллагене IV у многоклеточных форм жизни, которые появились на Земле очень давно. Это означает что аминокислоты, подобные цистеину, оказались в ходе эволюции в нужном месте, и природа не сочла нужным проводить дальнейшие эксперименты в поисках более совершенных механизмов.

Выпускница SFU Алаа Аль-Шаер внесла решающий вклад в успех исследованияИсточник: https://www.sfu.ca/
Нэнси Форд особо подчеркивает, что в этом исследовании ее подопечная впервые использовала АСМ-томографию для изучения стабильности коллагена при различных температурах и составления карты путей сворачивания и разворачивания белковых нитей. По мнению ученой, это невероятно перспективно для ответа на будущие вопросы о строении и функционале соединительной ткани. Форд поблагодарила Алаа Аль-Шаер и других аспирантов и студентов SFU за активное участие в исследовании и выразила уверенность, что это только начало.
В предыдущих научных работах по изучению стабильности коллагена использовались искусственные заменители — короткие нити синтетических пептидов. Это не могло дать полноценной картины, поскольку последовательности полноразмерных коллагеновых белков гораздо сложнее.

Нэнси Форд
научный руководитель исследования.
О том, помогают ли добавки с коллагеном похудеть, читайте в материале Hi-Tech Mail.

 6 часов назад
1
6 часов назад
1








 English (US) ·
English (US) ·  Russian (RU) ·
Russian (RU) ·